我司长效微晶注射剂获美国FDA临床许可
发布:2022-06-24
阅读:2864
近日,我司收到美国食品药品监督管理局(FDA)通知,默许我司开发的长效微晶混悬注射剂HNC364开展临床试验。并且,在药品审评过程中全程未收到IR(信息请求函),顺利获批。
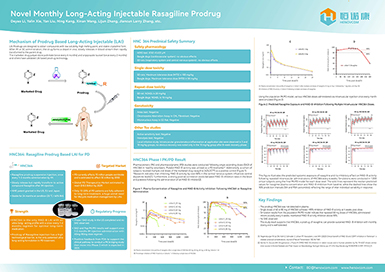
针对需长期用药的慢性疾病,我司通过微晶技术开发出长效混悬注射制剂, 建立了一个世界领先的前药技术平台。长效前药具有提高慢性病患者用药依从性,提高治疗效果等优势。恒诺康目前已有多个长效前药项目进入临床前阶段,HNC364是该技术平台第一个获批临床的505b(2)新药,也是国内首个获得FDA临床默许的长效混悬注射剂前药,可实现每月给药一次。
【关于HNC364】
HNC364是恒诺康具有化合物结构专利的雷沙吉兰前药,肌肉注射后可缓慢释放并在体内转化为原药雷沙吉兰,每月注射一次,用于原发性帕金森病的治疗。
帕金森病是继阿尔茨海默病之后第二种最为常见的神经变性病,中国约300万帕金森患者,占全球该类患者近1/3比例。伴随着老龄化的进程,我国帕金森病患者更是以每年10万人的速度递增,预计2030年将会达到500万人。
雷沙吉兰是第二代单胺氧化酶(MAO-B)抑制剂,能阻滞神经递质多巴胺的分解,与司来吉兰(第一代MAO-B抑制剂)相比抑制作用强5-10倍,对长期应用多巴制剂药效出现衰退的患者也有改善的作用,每天口服一次。另外,雷沙吉兰的代谢产物是一种无活性的非苯丙胺物质,副作用小,更重要的是,该药有一定的症状缓解的作用,并有较多证据证明该药物有一定的神经保护的作用。雷沙吉兰(商品名:Azilect)在全球帕金森药物市场占有率排名第二,占21.89%。